医薬品の副作用による被害を防止するためには情報を集めることが重要。
その情報をどのように集め、どのように生かすか。
1961年に起こったサリドマイド薬害事件を契機として、医薬品の安全性に関する問題を世界共通のものとして取り上げる気運が高まり、1968年、世界保健機関(WHO)加盟各国を中心に、各国自らが医薬品の副作用情報を収集、評価する体制(WHO国際医薬品モニタリング制度)を確立することにつながった。

そうだそうだ!過去から学んで薬害被害をなくすんだ!

副作用の情報を集めて生かすことが大切なんだね!
副作用情報等の収集
【医薬品・医療機器等 安全性情報報告制度】
報告の義務はみんなにある。
法第68条の10第2項の規定により、薬局開設者、病院、診療所若しくは飼育動物診療施設の開設者又は医師、歯科医師、薬剤師、登録販売者、獣医師その他の医薬関係者は、医薬品の副作用等によるものと疑われる健康被害の発生を知った場合において、保健衛生上の危害の発生又は拡大を防止するため必要があると認めるときは、その旨を厚生労働大臣に報告しなければならないとされている。

うおぉ、登場人物がいっぱい!

医薬関係者フルメンバーだ!

医薬品にかかわる全員だな!
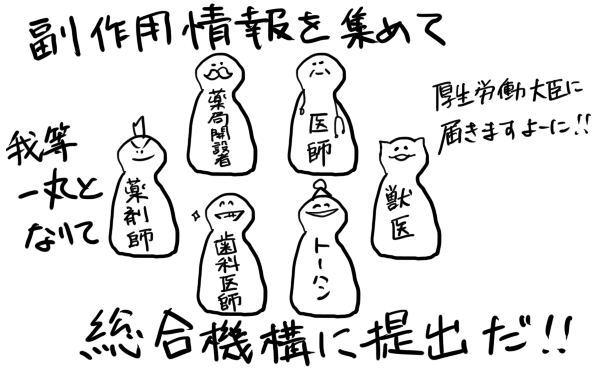

小さな店舗で勤務する、いち登録販売者にもその義務があります

つーわけで厚生労働大臣とはライン交換しときましょう

できるか!

実務上では、その報告書を総合機構※に提出することとされいて、そこから厚生労働大臣に報告されます
※独立行政法人 医薬品医療機器総合機構 略して総合機構

WHO加盟国の一員として、わが国が対応した安全対策に携わる制度の一つだ!
いつから?

これっていつからやってんの?

1967年3月。
サリドマイド訴訟の最中ですね

まだ裁判は終わっていないながらも、少しずつ改善を目指しているんだ

約3000の医療機関をモニター施設に指定して、厚生省(当時)が直接副作用報告を受ける「医薬品副作用モニター制度」としてスタートしました

医療機関約3000?!
すごい数だね!

一気に気合が入ったね!

これは医療機関でのことですが、一般用医薬品に関することも1978年8月に始まりましたよ!

これも約3000。
3000のモニター薬局だ!

把握した副作用事例を定期的に報告しています
その後、1997年7月に「医薬品等安全性情報報告制度」として拡充し、2002年7月には薬事法が改正され、医師や薬剤師等の医薬関係者による副作用等の報告を義務化することにより、副作用等に関する情報の収集体制がより一層強化された。

ちなみに「登録販売者」制度が導入されたのが2006年6月。それに伴い登録販売者もその一因に加わっています

登録販売者って、まだまだ歴史が浅いんだねぇ
【企業からの副作用等の報告制度】

製造販売業者(メーカーさん)にも、もちろん報告義務があります
製造販売業者等には、法第68条の10第1項の規定に基づき、その医薬品について、その副作用等によるものと疑われる健康被害の発生、その使用によるものと疑われる感染症の発生等を知ったときは、その旨を定められた期限までに厚生労働大臣に報告することが義務づけられている。

市販後も見直すべき点は見直し、より安全なものを目指すために医薬関係者に必要な情報を提供することが企業責任として重要とされています
1979年に創設された副作用・感染症報告制度において、医薬品等との関連が否定できない感染症に関する症例情報の報告や研究論文等について、製造販売業者等に対して国への報告義務を課している。

あとこれをみてくれ!
生物由来製品についてだ
それに加えて2003年7月からは、その前年に行われた薬事法改正により、血液製剤等の生物由来製品を製造販売する企業に対して生物由来製品の安全性について評価し、その成果を定期的に国へ報告する制度を導入している。
第一章の記事を参照

一般用医薬品に関しても、承認後の調査がメーカーさん等に求められています

副作用等の発現状況等の収集・評価を通じて承認後も安全対策を続けるんだ。

どうやって?
既存の医薬品と明らかに異なる有効成分が配合されたもの

ダイレクトOTCだっけ?

新しい成分だから慎重にならないとね
10年を超えない範囲で厚生労働大臣が承認時に定める一定期間(概ね8年)
承認後の使用成績等を製造販売業者等が集積し、厚生労働省へ提出する制度(再審査制度)が適用される。

10年を超えない、およそ8年くらいの間、厚生労働省に報告すること!

スイッチOTCってやつだ!

そう、初めて医療用から一般用になったもの
承認条件として承認後の一定期間(概ね3年)、安全性に関する調査及び調査結果の報告が求められている

承認してやる代わりに3年くらいの間、報告してこいよっ☆てこと
要指導医薬品も同じ

あ、これ企業の副作用等の報告内容とその期限です

丸暗記ガンーバ☆

いつもいつもそうやって突き放すのやめて!!

法則性をうまく見つけるんだ!
15日と30日!重篤かそうでないか!
| 副作用症例報告 | 報告期限 | |||
| 重篤性 | 国内事例 | 外国事例 | ||
| 医薬品によるものと疑われる副作用例の発生 | 使用上の注意から予測できないもの | 死亡 | 15日以内 | |
| 重篤(死亡を除く) | 15日以内 | |||
| 非重篤 | 定期報告 | - | ||
| 使用上の注意から予測できるもの | 死亡 | 15日以内 | - | |
| 重篤(死亡を除く):新有効成分含有医薬品として承認後2年以内 | 15日以内 | - | ||
| 市販直後調査などによって得られたもの | 15日以内 | - | ||
| 重篤(死亡を除く):上記以外 | 30日以内 | - | ||
| 非重篤 | - | - | ||
| 発生傾向が使用上の注意等から予測することができないもの | 重篤(死亡を含む) | 15日以内 | - | |
| 発生傾向の変化が保健衛生上の危害の発生または拡大の恐れがあるもの | 重篤(死亡を含む) | 15日以内 | - | |
| 感染症症例報告 | 報告期限 | |||
| 重篤性 | 国内事例 | 外国事例 | ||
| 医薬品によるものと疑われる感染症症例の発生 | 使用上の注意から予測できないもの | 重篤(死亡を含む) | 15日以内 | |
| 非重篤 | 15日以内 | - | ||
| 使用上の注意から予測できるもの | 重篤(死亡を含む) | 15日以内 | ||
| 非重篤 | - | - | ||
| 外国での措置報告 | 報告期限 | |||
| 外国における製造、輸入または販売の中止、回収、廃棄その他の保健衛生上の危害の発生または拡大を防止するための措置の実施 | - | 15日以内 | ||
| 研究報告 | 報告期限 | |||
| 副作用・感染症により、癌その他の重大な疾病、傷害もしくは脂肪が発生する恐れがあることを示す研究報告 | 30日以内 | |||
| 副作用症例・感染症の発生傾向が著しく変化したことを示す研究報告 | 30日以内 | |||
| 承認を受けた効能もしくは効果を有しないことを示す研究報告 | 30日以内 | |||
副作用情報等の評価及び措置

副作用情報が集まったら、どんな流れで世の中が変わっていくの?

調査・検討、意見の交換…そして厚生労働大臣による行政措置に至ります
- 総合機構(PMDA)
集まった情報を調査・検討し、専門委員に意見を聞く - 専門委員
総合機構に意見する - 薬事・食品衛生審議会
総合機構の調査・検討の結果について厚生労働大臣に意見する - 厚生労働大臣
薬事・食品衛生審議会の意見を聞いて行政措置を下す
収集された副作用等の情報は、その医薬品の製造販売業者等において評価・検討され、必要な安全対策が図られる。各制度により集められた副作用情報については、総合機構において専門委員の意見を聴きながら調査検討が行われ、その結果に基づき、厚生労働大臣は、薬事・食品衛生審議会の意見を聴いて、使用上の注意の改訂の指示等を通じた注意喚起のための情報提供や、効能・効果や用法・用量の一部変更、調査・実験の実施の指示、製造・販売の中止、製品の回収等の安全対策上必要な行政措置を講じている。

健康危機管理体制の整備
1997年に厚生省(当時)は、血液製剤によるHIV感染被害深く反省し、国民の信頼を回復するためには、健康危機管理体制を抜本的に見直すことが必要であるとの認識に立ち、健康危機管理、すなわち、医薬品、食中毒、感染症、飲料水等に起因する、国民の生命、健康の安全を脅かす事態に対して、健康被害の発生予防、拡大防止等の対策を迅速に講じていくための体制を整備した。

1997年はHIV訴訟をきっかけに改正された薬事法が施工された年ですね!

健康危機管理体制かぁ

詳しい内容は参照記事で!
参照記事




コメント